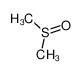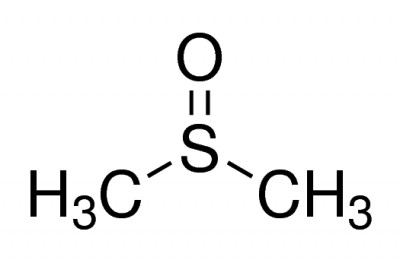
تصویر فرمول دی متیل سولفوکسید
دیمتیل سولفوکسید
(DMSO) یک ترکیب آلی حاوی گوگرد با فرمول شیمیایی (CH3)2SO است. این مایع بیرنگ،
پرکاربردترین سولفوکسید در مصارف تجاری به شمار میرود.
DMSO به عنوان یک حلال آپروتیک قطبی شناخته شده است
که قادر به حل کردن ترکیبات قطبی و غیرقطبی بوده و در طیف وسیعی از حلالهای آلی
به علاوه آب، قابل امتزاج است. نقطه جوش نسبتاً بالایی دارد.
DMSO پس از جذب توسط پوست، به ترکیباتی تبدیل میشود
که طعمی شبیه به سیر در دهان ایجاد میکنند.
از لحاظ ساختار شیمیایی، مولکول دارای
تقارن مطلوب Cs است.
این مولکول دارای هندسه مولکولی هرمی سهگانه است که با سایر ترکیبات سههمتای S(IV) سازگار است، با یک جفت
الکترون غیرپیوندی روی اتم گوگرد تقریباً چهاروجهی.
سنتز و تولید:
دیمتیل سولفوکسید برای اولین بار در سال 1866 توسط دانشمند
روسی، الکساندر زایتسف، سنتز شد و یافتههای او در سال 1867 گزارش شد. استفاده
مدرن از آن به عنوان حلال صنعتی از طریق محبوبسازی توسط تور اسمدلوند در شرکت
شیمیایی استپان آغاز شد. دیمتیل سولفوکسید صنعتی از دیمتیل سولفید، یک فرآورده
جانبی از فرآیند کرافت، با اکسیداسیون توسط اکسیژن یا دیاکسید نیتروژن تولید میشود.
واکنشها:
واکنش با الکتروفیلها: مرکز گوگرد در DMSO نسبت به الکتروفیلهای نرم
نوکلئوفیل و اکسیژن نسبت به الکتروفیلهای سخت نوکلئوفیل است. با متیل یدید،
ایودید تریمتیلسولفوکسونیوم، [(CH3)3SO]I تشکیل
میدهد:
(CH3)2SO + CH3I → [(CH3)3SO]I این
نمک با هیدرید سدیم دپروتونه میشود تا یلید گوگرد تشکیل دهد:
[(CH3)3SO]I + NaH → (CH3)2S(CH2)O + NaI + H2
اکسیدان: در
سنتز آلی، DMSO به
عنوان یک اکسیدان ملایم استفاده میشود. این ترکیب به عنوان پایهای برای چندین
واکنش اکسیداسیون مبتنی بر سولفونیوم شامل اکسیداسیون پفیتزنر-موفات، اکسیداسیون
کوری-کیم و اکسیداسیون سوِرن است. اکسیداسیون کورنبلوم از نظر مفهومی مشابه است.
اینها همگی شامل تشکیل یک گونه واسطهای سولفونیوم
(R2S+X که X یک
هترواتم است) هستند.
لیگاند و پایه لوییس: مرتبط
با تواناییاش در حل کردن بسیاری از نمکها، DMSO
یک لیگاند رایج در شیمی آلی است. نمونهای از این مورد،
کمپلکس دیکلروتتراکیس(دیمتیل سولفوکسید)روتنیوم(II)
(RuCl2(dmso)4) است. در این کمپلکس، سه لیگاند DMSO از طریق گوگرد به روتنیوم
پیوند خوردهاند. چهارمین DMSO از
طریق اکسیژن پیوند خورده است. به طور کلی، حالت پیوندی اکسیژنی شایعتر است.
حلال:
تقطیر DMSO نیازمند
خلا جزئی است تا نقطه جوش پایینتری به دست آید.
DMSO به عنوان یک حلال قطبی آپروتیک مورد استفاده
قرار میگیرد و نسبت به سایر اعضای این کلاس مانند دیمتیلفرمامید، دیمتیلاستامید،
ان-متیل-۲-پیرولیدون
و هگزامتیلفسفورامید (HMPA) کمتر
سمی است. DMSO بطور
گستردهای به عنوان حلال برای واکنشهای شیمیایی که شامل نمکها میشوند، از جمله
واکنشهای فینکلاشتاین و جایگزینیهای نوکلئوفیلی مورد استفاده قرار میگیرد.
همچنین به طور گسترده به عنوان یک عامل استخراج در بیوشیمی و زیستشناسی سلولی
استفاده میشود. چون DMSO تنها
اسیدی ضعیف است، به خوبی با پایههای نسبتاً قوی سازگار است و به همین دلیل به طور
گستردهای در مطالعه کربانیونها مورد استفاده قرار گرفته است. مجموعهای از
مقادیر pKa غیر
آبی (اسیدیتههای C-H، O-H، S-H و N-H) برای هزاران ترکیب آلی در
محلول DMSO تعیین
شده است.
به دلیل نقطه جوش بالای آن، ۱۸۹ درجه سانتیگراد (۳۷۲ درجه فارنهایت)، DMSO
به آرامی در فشار جوی معمولی تبخیر میشود. نمونههای حل
شده در DMSO نمیتوانند
به راحتی به دست آمده و در مقایسه با سایر حلالها، بسیار دشوار است تا همه ردپای DMSO را با تبخیر روتاری معمولی
حذف کرد. یک تکنیک برای بازیابی کامل نمونهها شامل حذف حلال آلی با تبخیر است که
به دنبال آن افزودن آب (برای حل کردن DMSO) و خشککردن با سرما برای حذف
هم DMSO و
هم آب میباشد. واکنشهای انجام شده در DMSO اغلب
با آب رقیق میشوند تا محصولات را رسوب دهند یا از محلول جدا کنند. نقطه انجماد
نسبتاً بالای DMSO، ۱۸.۵ درجه سانتیگراد (۶۵.۳ درجه فارنهایت)، به این
معنا است که در دمای اتاق یا کمی پایینتر، به صورت جامد است، که میتواند کاربرد
آن را در برخی فرآیندهای شیمیایی (مانند بلوریسازی با خنککردن) محدود کند.
در شکل دوترهی آن
(DMSO-d6)، به عنوان حلالی مفید برای طیفنگاری NMR به کار میرود، به دلیل توانایی آن در حل
کردن طیف وسیعی از آنالیتها، سادگی طیف خود، و مناسب بودن آن برای مطالعات طیفنگاری NMR در دمای بالا. معایب استفاده از DMSO-d6 شامل گرانروی بالای آن است
که باعث گسترش سیگنالها میشود، و هیدروسکوپیک بودن آن که منجر به برجستگی طنین H2O در طیف 1H-NMR
میشود. اغلب با
CDCl3 یا CD2Cl2 برای
کاهش گرانروی و نقاط ذوب ترکیب میشود.
DMSO به
عنوان حلال در آزمایشهای دارویی in vitro و in vivo به کار میرود. DMSO برای حل کردن ترکیبات
آزمایشی در برنامههای غربالگری کشف دارو
in vitro، از جمله برنامههای غربالگری با کارایی
بالا، استفاده میشود. این به دلیل توانایی آن در حل کردن ترکیبات قطبی و غیرقطبی،
استفاده برای نگهداری محلولهای اصلی ترکیبات آزمایشی (مهم هنگام کار با کتابخانههای
شیمیایی بزرگ)، قابل امتزاجی آسان با آب و محیطهای کشت سلولی، و نقطه جوش بالای
آن (که دقت غلظتهای ترکیب آزمایشی را با کاهش تبخیر در دمای اتاق بهبود میبخشد)،
است. یک محدودیت با DMSO این
است که میتواند بر رشد و زندهماندن خطوط سلولی تأثیر بگذارد، با غلظتهای پایین DMSO گاهی اوقات رشد سلولها را
تحریک کرده و غلظتهای بالای DMSO گاهی
اوقات باعث مهار یا کشتن سلولها میشود.
DMSO به
عنوان استفاده وسیله نقلیه در مطالعات in vivo ترکیبات
آزمایشی استفاده میشود. به عنوان مثال، به عنوان یک همحلال برای کمک به جذب
گلیکوزید فلاوونول ایکارین در کرم نماتد
Caenorhabditis elegans استفاده شده است. همانند
استفادهاش در مطالعات in vitro، DMSO
دارای برخی محدودیتها در مدلهای حیوانی است. اثرات پلیتروپیک
ممکن است رخ دهند و، اگر گروههای کنترل
DMSO به دقت برنامهریزی نشوند، اثرات حلال ممکن
است به اشتباه به داروی بالقوه نسبت داده شوند. به عنوان مثال، حتی یک دوز بسیار
پایین از DMSO اثر
محافظتی قوی در برابر آسیب کبدی ناشی از پاراستامول (آستامینوفن) در موشها دارد.
DMSO در
فرایندهای تولید برای تولید دستگاههای میکروالکترونیک استفاده میشود. به طور
گسترده برای جدا کردن فتورزیست در نمایشگرهای 'پنل تخت'
TFT-LCD و برنامههای بستهبندی پیشرفته (مانند بستهبندی
سطح ویفر / الگوی بامپ لحیمکاری) استفاده میشود.
DMSO یک حلال رنگ بر مؤثر است که ایمنتر از بسیاری
دیگر از آنها مانند نیترومتان و دیکلرومتان است.
بیولوژی DMSO
در واکنشهای زنجیرهای پلیمراز
(PCR) برای جلوگیری از ساختارهای ثانویه در قالب DNA یا پرایمرهای
DNA به کار میرود. این ماده قبل از واکنش به
مخلوط PCR اضافه
میشود، که با خودتطابقی DNA تداخل
ایجاد کرده و باعث کاهش واکنشهای مزاحم میشود.
DMSO در PCR برای پلاسمیدهای فوقالعاده مارپیچ (برای
شل کردن قبل از تکثیر) یا قالبهای DNA با
محتوای بالای GC (برای
کاهش پایداری حرارتی) کاربرد دارد. به عنوان مثال، غلظت نهایی ۱۰٪ DMSO در
مخلوط PCR با Phusion دمای آنیلینگ پرایمر (یعنی
دمای ذوب پرایمر) را ۵.۵
تا ۶.۰
درجه سانتیگراد (۹.۹
تا ۱۰.۸
درجه فارنهایت) کاهش میدهد.
همچنین به عنوان مادهای که چرخه سلولی
را در مرحله G۱ سلولهای لنفوئید
انسان به طور معکوس متوقف میکند، شناخته شده است.
DMSO ممکن
است نیز به عنوان یک کریوپروتکتانت استفاده شود، که به محیط سلولی اضافه میشود تا
تشکیل یخ را کاهش داده و از مرگ سلولها در طی فرآیند انجماد جلوگیری کند. تقریباً
۱۰٪ میتواند با روش انجماد
آهسته استفاده شود و سلولها میتوانند در دمای منفی ۸۰ درجه سانتیگراد (منفی ۱۱۲ درجه فارنهایت) منجمد شده
یا به صورت ایمن در نیتروژن مایع نگهداری شوند.
در کشت سلول، DMSO
برای القای تمایز سلولهای کارسینومای جنینی P19 به کاردیومیوسیتها و سلولهای عضله
اسکلتی استفاده میشود.
پزشکی استفاده
از DMSO در
پزشکی از حدود سال ۱۹۶۳
آغاز شد، زمانی که تیمی در دانشکده پزشکی دانشگاه علوم بهداشتی و علمی اورگن به
رهبری استنلی جیکوب کشف کردند که این ماده میتواند بدون آسیب رساندن به آنها از
پوست و دیگر غشاها نفوذ کند و ترکیبات دیگر را به یک سیستم بیولوژیکی حمل کند. در
پزشکی، DMSO عمدتاً
به عنوان یک مسکن موضعی، وسیله نقلیه برای کاربرد موضعی داروها، به عنوان یک ضد
التهاب و آنتی اکسیدان استفاده میشود. از آنجایی که
DMSO سرعت جذب برخی ترکیبات از طریق بافتهای
بیولوژیکی، از جمله پوست، را افزایش میدهد، در برخی از سیستمهای تحویل دارویی از
طریق پوست استفاده میشود. اثر آن ممکن است با افزودن
EDTA تقویت شود. اغلب با داروهای ضد قارچ ترکیب میشود،
که این امکان را فراهم میکند که نه تنها پوست بلکه ناخنهای پا و دست نیز نفوذ
کند.
DMSO برای
درمان شرایط و بیماریهای متعددی مورد بررسی قرار گرفته است، اما سازمان غذا و
داروی ایالات متحده (FDA) تنها
استفاده آن را برای تسکین علائم بیماران مبتلا به سیستیت بینابینی تأیید کرده است.
یک مطالعه در سال ۱۹۷۸
نشان داد که DMSO تسکین
قابل توجهی را به اکثریت ۲۱۳
بیمار مبتلا به اختلالات التهابی ادراری-تناسلی که مورد مطالعه قرار گرفته بود،
فراهم آورد. نویسندگان استفاده از DMSO را
برای شرایط التهابی ادراری-تناسلی که به دلیل عفونت یا تومور ایجاد نشدهاند و در
آن علائم شدید هستند یا بیماران به درمانهای معمول پاسخ ندادهاند، توصیه کردند.
در رادیولوژی مداخلهای، DMSO
به عنوان حلال برای الکل وینیل اتیلن در عامل امبولیزاسیون
مایع اونیکس استفاده میشود، که در امبولیزاسیون، انسداد درمانی عروق خونی به کار
میرود.
در کریوبیولوژی، DMSO
به عنوان کریوپروتکتانت استفاده میشود و همچنان یک ماده
مهم در مخلوطهای ویتریفیکاسیون کریوپروتکتانت است که برای حفظ اندامها، بافتها
و تعلیقهای سلولی به کار میرود. بدون آن، تا ۹۰٪ سلولهای منجمد غیرفعال
خواهند شد. این ماده به ویژه در انجماد و نگهداری طولانیمدت سلولهای بنیادی
جنینی و سلولهای بنیادی هماتوپویتیک مهم است که اغلب در ترکیبی از ۱۰٪ DMSO،
محیط انجماد و ۳۰٪
سرم جنین گاوی منجمد میشوند. در انجماد خطوط سلولی هتروپلوئید (MDCK، VERO و
غیره)، ترکیبی از ۱۰٪ DMSO با ۹۰٪ EMEM (۷۰٪ EMEM + ۳۰٪ سرم جنین گاوی +
مخلوط آنتیبیوتیک) استفاده میشود. به
عنوان بخشی از پیوند خودی مغز استخوان، DMSO با
سلولهای بنیادی هماتوپویتیک بیمار دوباره تزریق میشود.
DMSO با
تجزیهبهدو قسمت به دیمتیل سولفید و دیمتیل سولفون متابولیزه میشود. این ماده
از طریق دفع کلیهای و ریوی دفع میشود. یکی از عوارض جانبی احتمالی DMSO افزایش دیمتیل سولفید خون
است که میتواند علامت بوی بد دهان خونی را ایجاد کند.
طب مکمل DMSO
به عنوان یک داروی طب مکمل بازاریابی میشود. محبوبیت آن
به عنوان درمان جایگزین ناشی از یک مستند در برنامه ۶۰ دقیقه در سال ۱۹۸۰ است که یک طرفدار اولیه را
به تصویر میکشد. با این حال، DMSO در
برخی محصولات که توسط FDA آمریکا
به عنوان درمانهای سرطان جعلی لیست شدهاند، به کار رفته است و FDA با توزیعکنندگان این محصولات درگیری
داشته است. یکی از این توزیعکنندگان، میلدرد میلر است که
DMSO را برای انواع اختلالات تبلیغ کرده و در نتیجه
به جرم تقلب مدیکر محکوم شده است.
استفاده از
DMSO به عنوان درمان جایگزین برای سرطان خصوصاً
نگرانکننده است، زیرا نشان داده شده است که با داروهای شیمیدرمانی متعددی از
جمله سیسپلاتین، کاربوپلاتین و اوکسالیپلاتین تداخل دارد. شواهد کافی برای
پشتیبانی از فرضیهای که DMSO هرگونه
تأثیری دارد وجود ندارد و بیشتر منابع توافق دارند که تاریخچه عوارض جانبی آن در
آزمایشها، هنگام استفاده به عنوان مکمل غذایی که به شدت بازاریابی میشود، به
همراه ادعای معمول، احتیاط را ضروری میسازد.
دامپزشکی DMSO
به طور معمول در دامپزشکی به عنوان محلول برای اسبها، به
تنهایی یا در ترکیب با سایر مواد استفاده میشود. در موارد دوم، اغلب هدف از DMSO به عنوان حلال است، تا سایر
مواد را از طریق پوست منتقل کند. همچنین در اسبها، DMSO
به صورت وریدی، باز هم به تنهایی یا در ترکیب با دیگر
داروها استفاده میشود. برای درمان فشار داخل جمجمهای افزایش یافته و/یا ورم مغزی
در اسبها استفاده میشود.
طعم طعم
سیر مشهود هنگام تماس پوستی با DMSO ممکن
است به دلیل فعالسازی غیر بویایی گیرندههای
TRPA1 در گانگلیونهای تریجمینال باشد. برخلاف دیمتیل
و دیآلیل دیسولفیدها (که بویی شبیه به سیر دارند)، مونو- و تری سولفیدها (که
معمولاً بوهای نامطبوعی دارند)، و سایر ترکیبات گوگردی بودار، ماده شیمیایی خالص DMSO بیبو است.
امنیت سمیت
DMSO
حلالی غیر سمی است با دوز کشنده متوسط بالاتر از اتانول (DMSO: LD50، خوراکی، موش، ۱۴۵۰۰ میلیگرم بر کیلوگرم؛
اتانول: LD50،
خوراکی، موش، ۷۰۶۰
میلیگرم بر کیلوگرم).
آزمایشهای بالینی اولیه با DMSO به دلیل سؤالاتی در مورد
ایمنی آن، به ویژه توانایی آن برای آسیب رساندن به چشم، متوقف شد. عوارض جانبی که
بیشتر گزارش شدهاند شامل سردردها و سوزش و خارش هنگام تماس با پوست است. واکنشهای
آلرژیک شدید نیز گزارش شده است. DMSO میتواند
آلایندهها، سموم و داروها را از طریق پوست جذب کند که ممکن است اثرات غیرمنتظرهای
ایجاد کند. گفته میشود که DMSO اثرات
داروهای رقیقکننده خون، استروئیدها، داروهای قلبی، آرامبخشها و سایر داروها را
افزایش میدهد. در برخی موارد این میتواند مضر یا خطرناک باشد.
در استرالیا، DMSO به عنوان داروی برنامه ۴ (S4) طبقهبندی شده است، و یک شرکت به دلیل افزودن آن به محصولات به عنوان نگهدارنده مجرم شناخته شده است.
به دلیل توانایی نفوذ آسان DMSO به پوست، مواد حل شده در DMSO ممکن است به سرعت جذب شوند.
انتخاب دستکش در هنگام کار با DMSO مهم
است. دستکشهای ساخته شده از لاستیک بوتیل، الاستومر فلوری، نئوپرن، یا لاتکس ضخیم
(۱۵
میل / ۰.۴
میلیمتر) توصیه میشود. دستکشهای نیتریل، که در آزمایشگاههای شیمیایی بسیار
رایج هستند، ممکن است در برابر تماسهای کوتاه محافظت کنند اما گزارش شده است که
به سرعت با قرار گرفتن در معرض DMSO تجزیه
میشوند.
در ۹ سپتامبر ۱۹۶۵، وال استریت ژورنال گزارش
داد که یک تولیدکننده مواد شیمیایی هشدار داده است که مرگ یک زن ایرلندی پس از
درمان با DMSO برای
کشیدگی مچ دست ممکن است به دلیل درمان باشد، هرچند که هیچ کالبدشکافی انجام نشده و
ارتباط علتی برقرار نشده است. تحقیقات بالینی با استفاده از
DMSO متوقف شد و تا زمانی که آکادمی ملی علوم (NAS) در سال ۱۹۷۲ یافتههایی به نفع DMSO منتشر کرد، دوباره آغاز نشد.
در سال ۱۹۷۸،
FDA
آمریکا استفاده از
DMSO برای درمان سیستیت بینابینی را تأیید کرد. در
سال ۱۹۸۰،
کنگره آمریکا جلساتی را برگزار کرد که در آن ادعا شد
FDA در تأیید استفادههای دیگر پزشکی DMSO کند عمل کرده است. در سال ۲۰۰۷، FDA
به مطالعات بالینی استفاده از
DMSO در کاهش تورم بافت مغزی پس از آسیب مغزی
تروماتیک «وضعیت ردیابی سریع» اعطا کرد. قرار گرفتن
DMSO در معرض مغزهای در حال رشد موشها میتواند
باعث تحلیل مغز شود. این نوروتوکسیسیتی میتواند در دوزهایی به پایین تر از ۰.۳ میلیلیتر بر کیلوگرم تشخیص
داده شود، سطحی که در کودکانی که در طی پیوند مغز استخوان در معرض DMSO قرار میگیرند، فراتر رفته
است.
DMSO که
به فاضلابها دفع میشود میتواند مشکلات بو در پسابهای شهری ایجاد کند: باکتریهای
فاضلابی DMSO را
در شرایط بیهوازی (فقدان اکسیژن) به دیمتیل سولفید
(DMS) تبدیل میکنند که بویی شدید و نامطبوع مانند
کلم پوسیده دارد. با این حال، DMSO شیمیایی
خالص به دلیل عدم وجود پیوندهای C-S-C (سولفید)
و C-S-H (مرکاپتان)
بیبو است. بوزدایی از DMSO با
حذف ناخالصیهای بوداری که در آن وجود دارد، انجام میشود.
خطر انفجار دیمتیل
سولفوکسید میتواند با معرض قرار گرفتن در برابر کلریدهای اسیلی، واکنش انفجاری
ایجاد کند؛ در دمای پایین، این واکنش اکسیدانی برای اکسیداسیون Swern فراهم میکند.
DMSO همچنین
میتواند در دمای جوش خود ۱۸۹
درجه سانتیگراد در فشار نرمال، تجزیه شده و احتمالاً منجر به انفجار شود. این
تجزیه توسط اسیدها و بازها کاتالیز میشود و بنابراین میتواند حتی در دماهای
پایینتر نیز مرتبط باشد. واکنشهای قوی تا انفجاری همچنین در ترکیب با ترکیبات
هالوژنی، نیتریدهای فلزی، پرکلراتهای فلزی، هیدرید سدیم، اسید پریودیک و عوامل
فلورینه اتفاق میافتند.
موارد دیگر مرتبط
تغییر اکسیداسیون گوگرد دیمتیل سولفید (DMS)،
سولفید متناظر، همچنین توسط فیتوپلانکتونهای دریایی تولید شده و به جو اقیانوسی
تخلیه میشود که در آن به DMSO، SO2
و سولفات اکسیده میشود. دیمتیل
سولفون، معروف به متیلسولفونیلمتان (MSM)،
یک ترکیب مرتبط است که اغلب به عنوان مکمل غذایی بازاریابی میشود. ترکیبات مرتبط با متیل روی اکسیژن دیمتیل
سولفیت، سولفیت متناظر دیمتیل سولفات (همچنین DMS)، سولفات متناظر: یک ترکیب آلکیلهکننده
موتاژنیک متیل متانسولفونات، یک عامل متیله دیگر گلوریا رامیرز، که به عنوان
"زن سمی" شناخته میشود.
منابع داروی DMSO "دیمتیل سولفوکسید (DMSO) - فنی". شیمیهای
آتوفینا، دریافت شده در ۲۶
می ۲۰۰۷.
Matthews WS, Bares JE, Bartmess JE, Bordwell FG, Cornforth FJ, Drucker GE,
Margolin Z, McCallum RJ, McCollum GJ, Vanier NR (1975). "اسیدیتههای
تعادل کربن. VI. برپایی
یک مقیاس مطلق اسیدیتهها در محلول دیمتیل سولفوکسید".
J. Am. Chem. Soc. 97 (24): 7006-7014. doi:10.1021/ja00857a010. "دیمتیل
سولفوکسید". pubchem.ncbi.nlm.nih.gov. Novak KM,
ویرا. (2002). حقایق دارویی و مقایسهها (نسخه ۵۶). سنت لوئیس، میسوری: ولترز
کلوئر هلث. ص. 2345. ISBN 978-1-57439-110-7. Thomas R,
Shoemaker CB, Eriks K (1966). "ساختار مولکولی و
بلوری دیمتیل سولفوکسید، (H3C)2SO". Acta Crystallogr. 21 (1):
12-20. Bibcode:1966AcCry..21...12T. doi:10.1107/S0365110X66002263.
von Demselben (1867). "درباره
تأثیر اسید نیتریک بر روی متیل سولفید و اتیل سولفید" [در مورد اثر اسید
نیتریک بر متیل سولفید و اتیل سولفید]. در
Erlenmeyer, E.؛ Rieckher, T.؛ Volhard, J.؛ Liebig, J.؛ Wöhler, F. (ویرایش).
Annalen der Pharmacie (به زبان آلمانی). Meyer؛ Winter. ص.
148.
Gergel, Max G. (مارس
1977). "ببخشید آقا، آیا مایلید یک کیلوگرم ایزوپروپیل برومید بخرید؟" (PDF). شرکت شیمیایی پیرس. ص. 145.
Roy, Kathrin-Maria (15
ژوئن 2000), "سولفونها و سولفوکسیدها", انسایکلوپدیای شیمی صنعتی
اولمان، واینهایم، آلمان: نشر ویلی-ویسیاچ ورلگ
GmbH & Co. KGaA، doi:10.1002/14356007.a25_487، ISBN 3527306730
Epstein WW, Sweat FW (مارس
1967). "اکسیداسیونهای دیمتیل سولفوکسید". نقد شیمی. 67 (3): 247-260. doi:10.1021/cr60247a001. PMID 6042131.
Tidwell TT (1990). "اکسیداسیون
الکلها توسط دیمتیل سولفوکسید فعال و واکنشهای مرتبط: یک بهروزرسانی".
سنتز. 1990 (10): 857-870. doi:10.1055/s-1990-27036.
Calligaris M (2004). "ساختار
و پیوند در کمپلکسهای فلزی سولفوکسید: یک بهروزرسانی". نقد شیمی هماهنگی.
248 (3-4): 351-375. doi:10.1016/j.ccr.2004.02.005.
Laurence, Christian؛ Gal, Jean-François (2010). مقیاسهای
بنیادی و جذبی لوییس: دادهها و اندازهگیری. چیچستر، غرب ساسکس، بریتانیا: جان
وایلی. ص. 50-51. ISBN 978-0-470-74957-9. OCLC 428031803.
Cramer, R. E.؛ Bopp, T. T. (1977). "نمایش
گرافیکی انتالپیهای تشکیل مجموعه برای اسیدها و پایههای لوییس". آموزش
شیمی. 54: 612-613. doi:10.1021/ed054p612. نمودارهای
نشان داده شده در این مقاله با پارامترهای قدیمیتر استفاده شده است. پارامترهای E&C بهبود یافته در مدل ECW فهرست شدهاند.
"DMSO". exactantigen.com. آرشیو
شده از اصلی در 2009-10-05. بازیابی شده در 2009-10-02.
Bordwell FG (1988). "اسیدیتههای
تعادل در محلول دیمتیل سولفوکسید". حسابهای تحقیقات شیمی. 21 (12): 456-463. doi:10.1021/ar00156a004. S2CID 26624076.
"Bordwell pKa Table (Acidity in
DMSO)". آرشیو شده از اصلی در 9 اکتبر 2008. بازیابی
شده در 23 آوریل 2019.